Comité de Ética de la Investigación con medicamentos (CEIm)
Es el organismo independiente, constituido por profesionales sanitarios y miembros no sanitarios, encargado de velar por la protección de los derechos, la seguridad y el bienestar de los sujetos que participen en un ensayo clínico y de ofrecer garantía pública al respecto.
Su función es la supervisión y el control continuado de los ensayos clínicos, que deben cumplir la normativa vigente en cuanto a los aspectos metodológicos y éticos.

CEIm FIVO
Presidente:
D. Esteban Morcillo Sánchez (Farmacólogo Clínico).
Vicepresidente:
D. Ignacio Gil-Bazo (Médico Especialista en Oncología).
Secretario técnico:
D. Carlos Andrés Blasco (Farmacéutico Especialista en Farmacia Hospitalaria).
Vocales:
- Ismael Pastor Climente (Farmacéutico Especialista en Farmacia Hospitalaria).
- Joaquín Gavilá Gregori (Médico Especialista en Oncología).
- Ángel Luis Guerrero Zotano (Médico Especialista en Oncología).
- Dª Lourdes Bello Luna (Licenciada en Derecho).
- Dª Mª José Ortega García (Licenciada en Derecho).
- Julio Tudela Cuenca (Farmacéutico Especialista en Análisis Clínicos).
- Jose Luis Trillo (Farmacéutico de Atención Primaria).
- Luis Gómez de Membrillera Quesada (Especialista en Medicina Familiar y Comunitaria).
- David Hervás Marín (Licenciado Bioestadística).
- Dª Josefina Balaguer Cusi (Miembro Lego).
- Esteban Mesas Plaza (Grado en Enfermería).
- Dª Elena Oliete Ramírez (Médico Especialista en Medicina Familiar y Comunitaria).
- Antonio José Revert Ventura (Médico Especialista en Radiología).
- Miguel Ángel Sanz Alonso (Médico Especialista en Hematología).
Coordinador Secretaria Técnica CEIm:
Bernat Navarro Aguir (Licenciado en Farmacia)
La documentación a presentar para la evaluación de ensayos clínicos con medicamentos/ productos sanitarios es la indicada en el “Documento de instrucciones de la Agencia Española de Medicamentos y Productos Sanitarios para la realización de ensayos clínicos en España” y en el “Memorando de Colaboración e Intercambio de Información entre la Agencia Española de Medicamentos y Productos Sanitarios y los Comités de Ética de la Investigación con medicamentos”.
Documentos de la parte I para enviar a la AEMPS y al CEIm *
- Carta de presentación
- Formulario de solicitud
- Autorización del promotor al solicitante, si procede
- Resumen de protocolo
- Protocolo
- Manual del Investigador o ficha técnica del medicamento en investigación
- Ficha técnica o manual del investigador de los medicamentos no investigados (auxiliares)
- Asesoramiento científico y Plan de investigación Pediátrica
Documentos de la parte II para enviar solo al CEIm*
- Documentos en relación a los procedimientos y material utilizado para el reclutamiento de sujetos
- Documentos de hojas de información y consentimiento informado
- Idoneidad del investigador
Documentación a aportar por cada centro:
- Curriculum Vitae IP
- Idoneidad de las instalaciones
- Conflicto intereses IP
- Certificado BPC del IP
- Prueba de la cobertura de seguro o garantía financiera
- Memoria Económica
- Formulario datos de facturación tasas CEIm. La factura se emite tras completar el proceso de evaluación. Debe aportarse el documento completo junto con la solicitud. En el caso de solicitar exención, ver condiciones en el documento.
Para los ensayos clínicos con medicamentos, el promotor debe presentar la documentación a través del Portal de Ensayos Clínicos del Ministerio de Sanidad, Política Social e Igualdad.
Para los ensayos clínicos con productos sanitarios, el promotor debe presentar la documentación escaneada mediante un e-mail a la dirección ceim@fivo.org. En dicho e-mail, el Promotor debe indicar el título del estudio, código de protocolo, promotor e Investigador Principal de FIVO (si procede).
El promotor debe presentar toda la documentación escaneada (PDF) mediante un e-mail a la dirección ceim@fivo.org.
DOCUMENTACIÓN LOCAL (DESCARGAR REQUISITOS EOm):
En los EOm que en el momento de su presentación no dispongan de un dictamen favorable emitido por Comité de Ética de la Investigación con medicamentos (CEIm), se deberá presentar la siguiente documentación en formato PDF para su revisión por el CEIm-FIVO:
El promotor debe presentar toda la documentación escaneada mediante un e -mail a la dirección ceim@fivo.org
DOCUMENTACIÓN GENERAL: (Solo es necesaria en PDF)
- Carta de presentación (firmada). Solicitando la evaluación al CEIm-FIVO, en la que debe especificarse el promotor, el título del estudio, el código, el investigador principal en el centro y la relación de la documentación que se adjunta junto a la
- Formulario de registro estudio interno y/o ámbito universitario (firmado). Completar solo en el caso que el estudio sea de ámbito interno y/o
- Protocolo completo, adaptado en la medida de lo posible a la estructura y contenido que se detalla en el anexo I del “Real Decreto 957/2020, de 3 de noviembre, por el que se regulan los estudios observacionales con medicamentos de uso humano”. Podrá ser aceptado en inglés, con un resumen en la lengua oficial del Estado. Se indicará su versión y fecha.
- Hoja de información para los sujetos participantes y formulario de consentimiento informado, o justificación de su exención. Disponible modelo CEIm-FIVO. Se indicará su versión y fecha.
- Cuaderno de Recogida de Datos (CRD).
- Memoria económica general. Fuentes de financiación del estudio y compensaciones previstas para los sujetos participantes e investigadores, en su caso. En caso de tratarse de una investigación clínica sin ánimo comercial, el promotor deberá presentar una declaración responsable firmada por el promotor y por el investigador coordinador de que el estudio cumple con todas las condiciones referidas en el párrafo e) del artículo 2.2 del Real Decreto 1090/2015, de 4 de diciembre.
- Listado de investigadores de cada uno de los centros sanitarios en los que se propone realizar el estudio y número de sujetos participantes que se pretenden incluir en cada comunidad autónoma. Si el estudio se prevé realizar en otros países, listado de países.
- Acuerdo de delegación de responsabilidades (CRO) En caso de que la solicitud no la presente el promotor, esta deberá incluir un documento que indique las tareas delegadas por el promotor a la persona o empresa que actúa en su nombre. (si procede)
- Documentación de la aprobación del protocolo por el órgano correspondiente, en el caso de estudio impuesto al titular de autorización de comercialización de un medicamento por la autoridad nacional competente o la Comisión Europea. (si procede)
- Solicitud factura / Solicitud exención tarifas evaluación (firmada).
DOCUMENTACIÓN LOCAL (Se harán llegar a la Secretaría CEIm debidamente FIRMADA, según modelo propio del CEIm-FIVO):
NOTA:
- EOm promovido por Promotor externo: La gestión de esta documentación se solicitará al Coordinador de FINCIVO (coordinacion@fincivo.org) para que la gestione y haga llegar a Promotor.
- EOm promovido por IP de FIVO: La gestionará el propio Investigador.
- Compromiso del Investigador y autorización del Jefe de Servicio.
- Conformidad de servicio implicado. Pruebas extraordinarias y /o colaboración con otros servicios (únicamente cuando proceda).
- Formulario características generales del estudio.
- Cuestionario estudios con memoria económica 0€. Solo en el caso de estudios con memoria económica 0€.
- Compromiso de confidencialidad destinado a alumnos en prácticas. Solo en el caso de estudios de ámbito universitario.
- Cláusula de RGPD. Solo en el caso de estudios de ámbito universitario.
El estudio observacional con medicamentos (EOm) no podrá iniciarse en el centro hasta que no se obtenga la correspondiente conformidad de gerencia (el promotor es personal de FIVO) o firmarse el correspondiente contrato (el promotor es externo al centro). Para ello será condición mínima necesaria aportar justificación de haber recibido las autorizaciones de la financiación solicitada. Tanto la conformidad de dirección como el contrato debe solicitarse en la siguiente cuenta de correo electrónico: contratosestudios@fivo.org
El promotor debe presentar toda la documentación escaneada (PDF) mediante un e-mail a la dirección ceim@fivo.org.
DOCUMENTACIÓN A PRESENTAR (DESCARGAR REQUISITOS PROYECTOS EN PDF):
Se deberá presentar la siguiente documentación EN FORMATO PDF para su revisión por el CEI-FIVO:
DOCUMENTACIÓN GENERAL
1. Carta de presentación (firmada). Solicitando la evaluación al CEI-FIVO, en la que debe especificarse el promotor, el título del estudio, el código, el investigador principal en el centro y la relación de la documentación que se adjunta junto a la solicitud.
3. 1 Resumen del Protocolo.
5. Cuaderno de Recogida de Datos (CRD).
7. Informe de disponibilidad de muestras del BIOBANCO (solo si requiere muestras del biobanco).
8. Certificado de Seguro de Responsabilidad Civil (Art 18 ley 14/2007) (si procede).
9. Acuerdo de delegación de responsabilidades, en el caso de CRO (si procede)
DOCUMENTACIÓN LOCAL (remitir un original según modelo propio del CEIm-FIVO):
1. Compromiso del Investigador y autorización del Jefe de Servicio.
2. CV del equipo Investigador (se recomienda formato abreviado).
3. Conformidad de servicio implicado. Pruebas extraordinarias y /o colaboración con otros servicios (únicamente cuando proceda)
4. Informe del investigador principal.
5. Cuestionario estudios con memoria económica 0€. Solo en el caso de estudios con memoria económica 0€.
6. Compromiso de confidencialidad destinado a alumnos en prácticas. Solo en el caso de estudios de ámbito universitario.
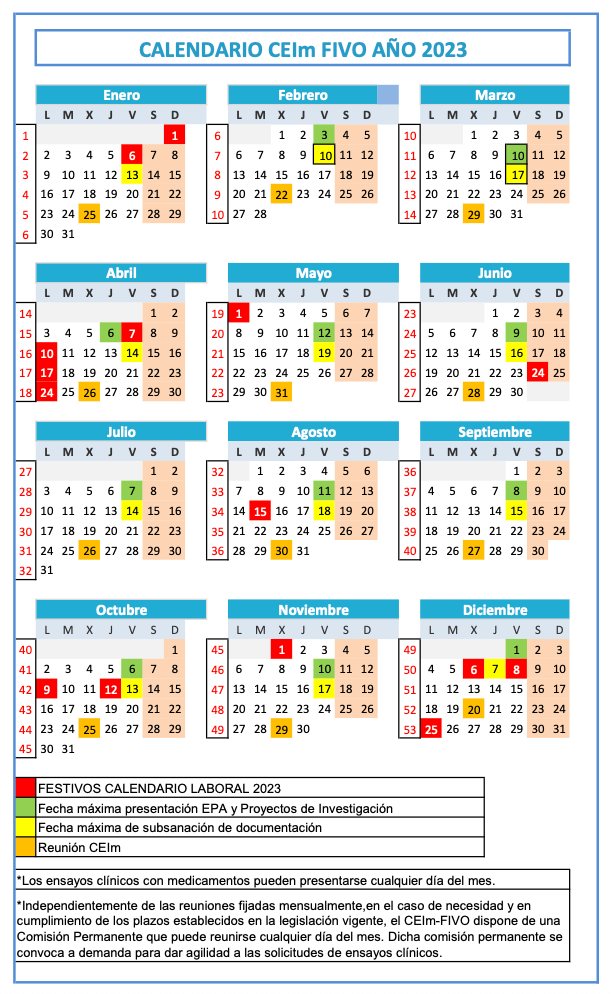
Plazo de presentación: Del día 1 al 10 de cada mes. Se podrá subsanar documentación hasta el día 15.
Secretaría Técnica CEIm
Bernat Navarro, Beatriz Llatas y Carmen Taltavull
E-mail: ceim@fivo.org
Teléfono: 96 069 4674 | 96 110 4673 | 96 111 4095
Dirección: Gregorio Gea, 31 CP 46009 – VALENCIA
Edificio D, 1ª Planta Secretaria Técnica CEIm
Gestión de contratos de Estudios Clínicos
En la Fundación Instituto Valenciano de Oncología, el Director Médico es la persona autorizada para firmar el documento de idoneidad de las instalaciones.
Para solicitar la tramitación de firma de este documento, el promotor/CRO puede enviar un correo electrónico a: contratosestudios@fivo.org
En la solicitud deberá adjuntarse la siguiente documentación e información (DESCARGAR REQUISITOS GESTION IDONEIDAD INSTALACIONES EN PDF):
- Protocolo en español o en su defecto el protocolo en ingles más sinopsis en español.
- Modelo de idoneidad de las instalaciones cumplimentado con los datos del estudio indicando los servicios implicados que participaran en el estudio.
- Memoria Económica General
Además, en el correo electrónico de solicitud deben indicarse los siguientes datos:
- Nombre del investigador principal
- Servicio del Hospital en el que se realizará el estudio
- Si necesitan el documento con firma original o es suficiente con el escaneo en PDF
Los contratos de ensayos clínicos que se firmen con la Fundación Instituto Valenciano de Oncología, se gestionarán siguiendo las instrucciones que se describen a continuación.
El correo electrónico de contacto para la negociación de los contratos es contratosestudios@fivo.org
La documentación e información a aportar por parte del promotor para completar el expediente interno del centro (DESCARGAR REQUISITOS GESTION CONTRATOS EECC EN PDF):
1. Protocolo en inglés o castellano
2. Resumen del protocolo en castellano.
3. HIP/CI
4. Anexo 1A (si está disponible en el momento de firma)
5. Certificado Póliza de seguro. Debe constar la siguiente información:
Centro: Fundación Instituto Valenciano de Oncología
Dirección del Centro: C/ Profesor Beltrán Báguena, 8 46009 Valencia
Fundación: Fundación de Investigación Clínica del Instituto Valenciano de Oncología (FINCIVO)
Dirección de la Fundación: C/ Ricardo Micó, nº 3 – Local nº 1 46009 Valencia
Investigador principal.
7. Poderes/delegación (CRO). Justificación de la representación de las partes firmantes en el contrato.
8. Dictamen CEIm (si está disponible en el momento de firma)
9. Autorización AEMPS (si está disponible en el momento de firma)
10. CV del IP
12. Nombre del CEIm y estado de la solicitud al CEIm y a la AEMPS. Completar formulario adjunto.
MEMORIA ECONÓMICA LOCAL
Paralelamente se debe negociar el anexo de la memoria económica local con Bernat Navarro bnavarro@fivo.org (TELEFONO 96 069 4674). Dependiendo de cómo se firmará el contrato se debe utilizar uno de los siguientes modelos:
– Modelo Anexo Memoria Económica interna FIVO contrato castellano.
– Modelo Anexo Memoria Económica Interna FIVO contrato bilingüe.
SON DOS PROCESOS GESTIONADOS DE MANERA INDEPENDIENTE
– El cuerpo del contrato se negocia en contratosestudios@fivo.org (No poner en copia a esta dirección en los correos que van dirigidos a la negociación de la memoria económica local)
– La memoria económica local se negocia directamente con bnavarro@fivo.org (No poner en copia a esta dirección en los correos que van dirigidos a la negociación del cuerpo del contrato). Una vez cerrado el Anexo de memoria económica local, podrá ser volcado en el contrato.
Tras la publicación del Decreto 73/2009, de 5 de junio, del Consell, por el que se regula la gestión de ensayos clínicos y estudios postautorización observacionales con medicamentos y productos sanitarios. [2009/6667], se utilizarán los siguientes modelos de contrato:
- MODELO CONTRATO EC FIVO CASTELLANO
- MODELO CONTRATO EC FIVO BILINGÜE
- MODELO CONTRATO EPA FIVO CASTELLANO
- MODELO CONTRATO PROYECTOS FIVO CASTELLANO
En caso de producirse una extensión del estudio clínico, un cambio de Investigador Principal o bien una Modificación Relevante que lleve implícito un aumento o disminución del coste del estudio clínico inicialmente previsto se realizará una adenda al contrato.
Se utilizarán los siguientes modelos de adendas:
*En el caso de que sea necesario firmar la adenda en bilingüe, se requiere aportar traducción jurada, adjuntando certificado de traductor jurado acreditado por el Ministerio de Asuntos Exteriores
Secretaria Investigación FIVO
Bernat Navarro, Beatriz Llatas y Carmen Taltavull
E-mail: contratosestudios@fivo.org
Teléfono: 96 110 4673 | 96 111 4095
Dirección: Gregorio Gea, 31 CP 46009 – VALENCIA
Edificio D, 1ª Planta Secretaria Investigación FIVO
Ensayos clínicos en el IVO
El Instituto Valenciano de Oncología ha participado en el desarrollo de la mayoría de los nuevos fármacos contra el cáncer comercializados en los últimos 20 años y actualmente es uno de los centros del país que cuenta con más ensayos clínicos con fármacos oncológicos.




